Аллергия и наследственность: особенность общая, последствия разные
Содержание статьи
Наследственные причины аллергий. Генетика атопийСуществует наследственная предрасположенность к атопическим заболеваниям. Однако при таких заболеваниях, как бронхиальная астма, диффузный нейродермит и аллергический ринит, в развитии которых взаимодействуют наследственные и средовые факторы, крайне трудно выделить роль определенных генов. Клиническая картина при этих заболеваниях, по всей вероятности, определяется сложным взаимодействием многих генетических локусов, и характерная для любой атопической болезни вариабельность фенотипа зависит от изменений в каждом из этих локусов. Ситуация еще более осложняется тем, что разные аллергические заболевания могут иметь одни и те же генетические маркеры. Например, атопию часто выявляют по немедленной реакции на внутрикожное введение аллергенов и повышенному уровню IgE в крови, тогда как бронхиальная астма характеризуется повышенной реактивностью дыхательных путей. В основе аллергических заболеваний лежат изменения по крайней мере двух групп генов. Одни из них контролируют системные проявления атопии, общие для различных аллергических заболеваний (например, повышение синтеза IgE и эозинофилию), а другие определяют местные воспалительные реакции в отдельных органах-мишенях (например, в коже при диффузном нейродермите или в легких при бронхиальной астме). Исследование генома больных диффузным нейродермитом выявили ассоциацию этого заболевания с изменением в хромосомах lq21,3q21, 17q25 и 20р. Эти участки тесно связаны с известными локусами псориаза. Локус lq21 содержит кластер генов, влияющих на дифференцировку эпидермиса. Главные подходы к выявлению генов, ответственных за атопические болезни, включают 1) идентификацию генов-кандидатов, основанную на поиске полиморфизмов, способных изменять функцию или экспрессию известных генов, продукты которых участвуют в патогенезе атопии или воспаления; 2) позиционное клонирование специфических областей хромосомы, ассоциированных с наследованием болезни. Физическое картирование этих областей позволяет идентифицировать локализованные в них гены. Затем гены-кандидаты исследуют на предмет наличия мутаций или специфических полиморфизмов. Известно несколько генов-кандидатов, ассоциированных с атопическими болезнями. Сцепление и значительную ассоциацию с атопическими заболеваниями обнаруживают отдельные аллели генов на хромосомах 5, 6, 11, 12 и 14.
Хромосома 5. Сегмент 5q23-35 содержит несколько генов, возможно, причастных к патогенезу аллергических заболеваний. К ним относятся тены, кодирующие цитокины Тh2-клеток (ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-13 и ГМ-КСФ). В качестве кандидата особенно подробно исследован ген ИЛ-4. Замена цитозина на тимидин в положении 589 промоторной области гена ИЛ-4 приводит к появлению необычного сайта связывания фактора транскрипции NF-AT (ядерный фактор активированных Т-клеток), повышению сродства его связывания, усилению транскрипции гена ИЛ-4 и возрастанию продукции IgE. Это согласуется с важной ролью ИЛ-4 в развитии Тh2-клеток и переключении синтеза классов иммуноглобулинов на синтез IgE. К другим генам этой хромосомы, способным влиять на развитие аллергических реакций, относятся гены синтазы лейкотриена С4, гены рецептора М-ГСФ, глюкокортикоидного рецептора и b2-адренорецептора. Хромосома 6. На этой хромосоме расположены гены, кодирующие HLA I и II классов, которые регулируют специфичность и интенсивность иммунного ответа на специфические аллергены. Здесь локализованы и гены, играющие центральную роль в процессе распознавания и представления антигенов, в том числе гены транспортеров, участвующих в обработке антигенов (ТАР). Реакции IgE на специфические аллергены (такие, как антиген амброзии Amb a V и аллерген пылевого клеща Der p 1) сцеплены с определенными локусами HLA класса II. На хромосоме 6 находится и ген ФНО-а — главного цитокина, участвующего в привлечении клеток в очаг воспаления. Найдена ассоциация полиморфизмов гена ФНО-а с бронхиальной астмой. Хромосома 11. Рядом исследований доказана связь атопии с сегментом Hql3. В качестве расположенного здесь гена-кандидата рассматривается ген, кодирующий |3-субъединицу высокоаффинного рецептора IgE (FceRI-b), которая ускоряет проведение внутриклеточного сигнала от этого рецептора. Обнаружена ассоциация нескольких генетических вариантов FceRI-b с бронхиальной астмой, повышенной реактивностью бронхов и диффузным нейродермитом. Хромосома 12. Бронхиальная астма и другие атопические заболевания связаны и с особенностями хромосомы 12. На ее длинном плече локализуется ряд генов-кандидатов — ИФН-у, NO-синтазы, ФСК, -6, ИФР-1 и b-субъединицы ядерного фактора-Y. ИФН-у способствует развитию Тh2-клеток и угнетает функцию Тh2-клеток; -6 активируется ИЛ-4 и принимает участие в индукции переключения синтеза иммуноглобулинов на синтез IgE и дифференцировке Тh2-клеток, а ФСК поддерживает пролиферацию и дифференцировку тучных клеток. Другие хромосомы. На хромосоме 14 локализован ген ос-цепи TCR, которая играет важную роль в распознавании аллергенов. Обнаружена выраженная ассоциация реакций IgE на ряд аллергенов и общего уровня IgE в сыворотке крови с некоторыми ос-изотипами TCR, свидетельствующая о роли этого гена в модификации специфических реакций IgE. Найдена также связь между атопией и усиливающим функцию полиморфизмом гена а-субъединицы рецептора ИЛ-4, который расположен на хромосоме 16. Имеются данные и о связи бронхиальной астмы с сегментами 17р12-qll.2, где локализованы гены, кодирующие хемокины RANTES и эотаксин, которым принадлежит основная роль в привлечении эозинофилов в дыхательные пути при бронхиальной астме. Гены могут влиять на течение аллергических заболеваний и иными путями, определяя, например, эффективность лечения кортикостероидами, b2-адреномиметиками и средствами, изменяющими метаболизм лейкотриенов. По некоторым данным, присутствие глутамата в положении 27 b2-адренорецептора ассоциировано с меньшей реактивностью дыхательных путей при бронхиальной астме. Присутствие глицина в положении 16 этого рецептора ассоциировано с ночным падением ОФВ1. Полиморфизм промотора гена 5-липоксигеназы сказывается на синтезе лейкотриенов. Наконец, полиморфизм промотора гена ИЛ-4 с ускорением его транскрипции ассоциирован с резистентностью к кортикостероидам и тяжелым течением бронхиальной астмы. В связи с этим следует отметить, что совместное воздействие ИЛ-2 и ИЛ-4 придает Т-лимфоцитам резистентность к кортикостероидам. — Также рекомендуем «Эпидемиология (распространенность) аллергических заболеваний — атопий» Оглавление темы «Аллергические реакции у детей»:
|
Источник
Аллергия и наследственность: особенность общая, последствия разные
Известно ли вам, что «дыхательная» аллергия у родителей, может проявиться атопическим дерматитом у ребенка? Какова вероятность передачи «гена» аллергии? И чем сенсибилизация отличается от аллергии?
«Ген» аллергии
Термин «аллергия» впервые ввел в использование венский педиатр Клеменс фон Пирке еще в 1906 году, для обозначения необычной реакции некоторых детей на введение противодифтерийной сыворотки.
Название «аллергия» было заимствовано им из древнегреческого, и переводится буквально как «действую по-другому». В этом и заключается суть аллергии: иммунная система начинает защищаться от нейтральных, и даже полезных, для большинства людей веществ. А в основе такой гиперреактивности в 85% случаев лежит генетическая особенность.
Исследования последних лет пока не смогли убедительно доказать «вину» какого-то одного гена в развитии аллергии, и на сегодня «группа подозреваемых» насчитывает около 150 вариантов. Среди которых 40 — встречаются значительно чаще других.
Здесь и гены, кодирующие особенности барьерной функции эпителия (например, FLG, участвующий в развитии атопии), и цитокины, и многие другие.
А вероятность наследования одного из таких генов достигает 40-45%, если только один родитель страдает от аллергии, и до 75-80% — если оба.
Нельзя исключать и случайные мутации генов ребенка от «аллерго»-здоровых родителей. Правда вероятность появления аллергии при таких условиях не превышает 15%.
Аллергия или сенсибилизация
По своей сути, аллергия — защитная реакция иммунитета. Правда направлена такая защита на обычно безопасные объекты окружающей среды.
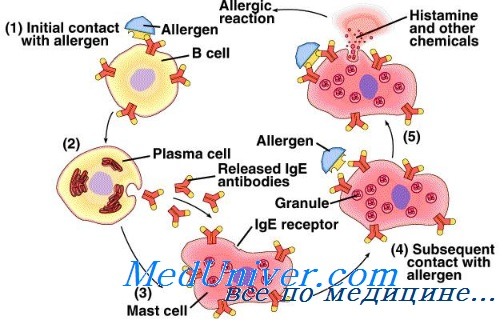
Кроме того, в отличие от других защитных механизмов, первая встреча с «непонравившимся» веществом вызывает только формирование «воспоминаний» — антител IgE. А реакция, как таковая, разворачивается «во всей красе» только при повторной и последующих встречах с аллергеном.
Наличие таких «неприятных воспоминаний» и называется сенсибилизацией, и отражает готовность организма выдать аллергическую реакцию.
Чем больше концентрация IgE к объекту, тем больше сенсибилизация и выше риск яркой аллергической реакции.
Например, если насморк, кашель и чихание возникают:
- в помещениях, где имеется плесень (угловые комнаты, балконы, под обоями, в ванной комнате) — стоит проверить уровень IgE к плесневым грибам;
- в определенный сезон года (весной, летом, осенью) — к сорным и злаковым травам, а также деревьям, цветение которых совпадает с аллергией;
- сразу после сна — оценить IgE к клещу перинному, пуху или перьям подушек (гусиное, утиное и другие).
Анализ актуален и для продуктов питания, правда с некоторой оговоркой — большинство продуктов имеют поликомпонентный состав.
Так, в составе даже «чистых» видов шоколада присутствуют следовые концентрации орехов, молока, глютена и некоторых других веществ. А любая выпечка — это микст из дрожжей, зерновых культур, яиц и других компонентов.
Кроме того, за один прием пищи, большинство людей, употребляют сразу несколько видов продуктов, а значит и «угадать» на какой из них «пошла» аллергия — чаще всего крайне сложно.
В этом случае можно использовать панели из наиболее распространенных аллергенов. Например, аллергокомплекс пищевой RIDA-screen №3, включающий наиболее аллергенных представителей практически всех пищевых групп (овощи, фрукты, морепродукты, орехи, мука и другие). Или панели по группам — овощи, фрукты, орехи, рыбы, мясо и другие.
Источник
Выявлено пять участков генома, связанных с пищевой аллергией

Генетические механизмы возникновения аллергии до сих пор плохо известны. Больше всего проблем вызывает пищевая аллергия, которая имеет отсроченное действие и очень широкий спектр возможных симптомов. Часто достоверно диагностировать пищевую аллергию просто не удается. В недавнем исследовании, проведенном в Германии, ученым удалось установить пять независимых участков человеческого генома, ответственных за наличие пищевой аллергии. Все эти участки оказались связаны с регулировкой иммунного ответа и функционированием так называемого эпителиального барьера на слизистых пищеварительной системы. По предположению авторов, пищевая аллергия возникает во многом благодаря нарушению этого защитного барьера, попаданию за его пределы избыточного количества аллергена и отклонениям в работе лейкоцитов.
В последнее время все больше детей и взрослых страдают от аллергии — повышенной чувствительности иммунной системы к тем или иным веществам из внешней среды (аллергенам). В ответ на контакт организма с таким веществом (контактирование может происходить разными путями: через кожу, слизистые дыхательных путей, пищеварительную систему) начинается воспаление, вырабатываются антитела к этому веществу. Появляются внешние признаки воспаления: покраснение, насморк, чихание, сыпь, отеки и т. д.
По тому, как аллерген должен попасть в организм, чтобы вызвать соответствующую реакцию, выделяют разные типы аллергии. Зачастую одно и то же вещество может быть безвредным на коже, а попадая в пищеварительную систему, может вызывать сильнейшую аллергическую реакцию. Пищевая аллергия особенно разнообразна на симптомы и степень их выраженности и может представлять серьезную опасность, так как является основной причиной анафилактического шока.
Одни люди более склонны к заболеваниям аллергического спектра, другие — менее. Подобная склонность зависит от окружающей среды и истории контактов человека с теми или иными возможными аллергенами, а также — от наследственности, то есть от генов. Ученые активно занимаются исследованием того, как именно появляется у людей это заболевание и почему в последние годы число болеющих растет, однако многое так и остается пока неизвестным.
В развитых странах 4-8% жителей страдают хотя бы от одного вида пищевой аллергии (S. H. Sicherer, H. A. Sampson, 2014. Food allergy: Epidemiology, pathogenesis, diagnosis, and treatment). Вообще, оказывается, что довольно сложно диагностировать все пищевые аллергены для сколько-нибудь большой группы пациентов. В отличие от кожной аллергии, где методика оценки аллергической реакции разработана относительно хорошо, диагностика пищевой аллергии вызывает ряд трудностей. Ранее в основном использовались специализированные опросники, то есть пациенты сами сообщали о наличии или отсутствии симптомов аллергии у себя или своих детей. Но было показано, что около 80% таких сообщений не подтверждаются экспериментально. Реакция на пищевые продукты может быть отсроченной, не всегда пациент принимает в расчет все употребленные в последнее время продукты, а многие кажущиеся симптомы пищевой аллергии могут иметь совершенно иную причину, которую не так-то просто отследить. И, конечно, не стоит забывать о склонности нашего мозга находить взаимосвязи там, где их нет.
Тестирования, при которых пациентам в контролируемых условиях дают предполагаемые аллергены, а затем наблюдают за симптомами, гораздо точнее. Однако и их результаты могут сильно различаться в зависимости от конкретной методики. Так, по виду и вкусу продукта пациент в большинстве случаев знает, что ему дают, и срабатывает эффект плацебо. От уверенности в том, что у человека есть аллергия на данный продукт, у него может даже повышаться уровень иммуноглобулинов, свидетельствующих о воспалении. Симптомы пищевой аллергии столь разнообразны, что для верности исследователи записывают просто всё, что происходит с организмом пациента в тестируемый период. Это опять же приводит к завышенным оценкам количества случаев пищевой аллергии.
В последние годы используют более точный метод оценки аллергической реакции — Oral food challenge (OFC), который уже показал свою эффективность (H. A. Sampson et al., 2012. Standardizing double-blind, placebo-controlled oral food challenges). Пациентам дают небольшую стандартизированную порцию аллергена в такой форме, чтобы они не знали, какой получают продукт. Достоверными считают лишь те симптомы, которые при повторении теста стабильно возникают через одинаковое время после получения продукта и не повторяются при получении неаллергенных продуктов.
Исследователи из Германии провели полногеномный поиск ассоциаций между геномными вариантами и фенотипическими проявлениями пищевой аллергии. Они проанализировали последовательности ДНК 497 аллергиков и 2387 человек, не имеющих аллергических реакций. По данным предыдущих исследований, в младенчестве чаще всего болеют непереносимостью коровьего молока и куриных яиц, у детей постарше очень распространена аллергия на арахис (B. I. Nwaru et al., 2014. Prevalence of common food allergies in Europe: a systematic review and -analysis). Эти три типа пищевой аллергии были выбраны для дальнейшего анализа. Данные об аллергии были собраны методом OFC.
Ученые выясняли, на каких участках хромосом у аллергиков по сравнению со здоровыми людьми повышена изменчивость за счет однонуклеотидных замен (SNP): сравнивались полные последовательности ДНК всех участников исследования между «здоровыми» и «больными». У каждого человека своя особенная последовательность нуклеиновых кислот, но если разделить геном на отдельные гены, то у каждого гена будет несколько вариантов, в которых этот ген может существовать. Вот количество таких вариантов и интересовало ученых: если у больных людей таких вариантов было значительно больше, чем у здоровых, то у данного участка предполагали наличие связи с заболеванием аллергией. Неправильных способов «собрать» что-нибудь всегда больше, чем правильных, поэтому повышенное разнообразие в некотором участке хромосомы наводит на мысль о том, что именно в этом участке у больных что-то сломано. На данном этапе не важно, как именно оно сломано — у всех это даже может быть по-разному, — важно, какие гены работают у больных неправильно. Таким путем можно определить, работа каких генов должна идти нормально, чтобы аллергии не было.

В результате исследователи нашли пять участков ДНК, где чаще всего встречаются нарушения у людей с аллергией на арахис, яйца и коровье молоко. Первый участок лежит на первой хромосоме и относится к комплексу, ответственному за нормальное развитие эпидермиса. Он непосредственно примыкает к гену филаггрина (Filaggrin, filament aggregating protein) — структурного белка, участвующего в формировании защитного эпителиального барьера. Мутации в этом гене тесно связаны с экземой — воспалительным заболеванием кожи сложной природы, в возникновении которого большую роль отводят нарушениям иммунитета. По причинам возникновения и проявлениям оно близко к заболеваниям аллергического спектра и часто бывает у аллергиков. Исследователи дополнительно проверили корреляцию между найденным SNP и заболеванием аллергией, исключив из выборки больных экземой. Мутация оказалась связанной с пищевой аллергией всех трех типов, независимо от наличия или отсутствия экземы у носителя. Ген филаггрина работает в основном на слизистых ротовой полости и пищевода, при нарушении его работы именно в этих участках формируется дефективный кожный барьер, пропускающий внутрь организма избыточное количество аллергена.
Еще один участок был обнаружен между генами интерлейкина 4, интерлейкина 13 и одним из генов цитокинов на пятой хромосоме. Нарушения на данном участке также часто связывают с экземой, однако и здесь корреляция с аллергией обнаружилась как в группе исследуемых с экземой, так и в группе без неё. Оба упомянутых интерлейкина принимают участие в воспалительной реакции во время аллергии, связаны с работой лимфоцитов крови и регуляторных Т-клеток слизистых поверхностей.
Третий участок находится на одиннадцатой хромосоме. В нем была обнаружена одна однонуклеотидная замена, которая одновременно связана как с экземой, так и с пищевой аллергией на арахис, яйца и коровье молоко. В группе без экземы связь этой мутации с аллергией показать не удалось. По предыдущим работам известно, что нарушения в этом участке также связаны и с другими типами аллергии, в том числе пищевой и кожной. Получается, что нарушения в этом участке одновременно приводят к целому ряду аллергических заболеваний, а не только к пищевой аллергии.
Повышенную изменчивость, связанную с пищевой аллергией, нашли на участке генов, кодирующих белки серпины, на восемнадцатой хромосоме. Два самых частых SNP на этом участке оба оказались в регуляторных частях генов. Один находится на участке, регулирующем работу генов иммунного и воспалительного ответа, в том числе и Т-клеток второго типа (Type 2 helper T cells; см. подтипы Т-хелперов), другой задействован в тканеспецифичной экспрессии серпина В10 в крови. К сожалению, функции белка серпина В10 пока не изучены, но известно, что он экспрессируется также в коже и слизистых.
Наконец, ученые подтвердили связь нарушений на участке человеческих лейкоцитарных антигенов шестой хромосомы с пищевой аллергией на арахис; другие пищевые аллергии оказались с данным участком не связаны.
Все выявленные участки вместе определяют приблизительно на 10,2% вероятность наличия пищевой аллергии трех изучаемых типов. Остальная изменчивость объясняется другими, еще не выявленными, генами и, конечно, внешними условиями.
Во время развития воспаления в рамках астмы или экземы наблюдается повышение активности серпинов и интерлейкинов 4 и 13, активированных с участием Т-клеток второго типа. Исследование пищевой аллергии на арахис, куриные яйца и коровье молоко показало, что связанные с заболеванием нарушения находятся в регуляторных участках генов, кодирующих те же самые звенья. Кроме того, как экзема, так и пищевая аллергия тесно связаны с нарушением работы эпителиального барьера. Для пищевой аллергии наиболее важна дефектность защитного барьера слизистых верхней части пищеварительной системы.
Ранее исследователи ограничивались лишь пищевой аллергией на арахис и во многом полагались на менее достоверные способы постановки диагноза. В этой работе большая выборка, более точные методы выявления аллергии и исследование трех типов аллергии одновременно позволили обнаружить сразу пять участков хромосом, нарушения в которых ассоциируются с пищевой аллергией и другими аллергическими заболеваниями.
Источник: Ingo Marenholz, Sarah Grosche, Birgit Kalb, Franz Rüschendorf, Katharina Blümchen, Rupert Schlags, Neda Harandi, Mareike Price, Gesine Hansen, Jürgen Seidenberg, Holger Röblitz, Songül Yürek, Sebastian Tschirner, Xiumei Hong, Xiaobin Wang, Georg Homuth, Carsten O. Schmidt, Markus M. Nöthen, Norbert Hübner, Bodo Niggemann, Kirsten Beyer & Young-Ae Lee. Genome-wide association study identifies the SERPINB gene cluster as a susceptibility locus for food allergy // Nature Communications. 2017. DOI: 10.1038/s41467-017-01220-0.
Алёна Сухопутова
Источник