Терапия острых аллергических состояний на догоспитальном этапе
Содержание статьи
Терапия острых аллергических состояний на догоспитальном этапе
К острым аллергическим заболеваниям относят анафилактический шок, обострение (приступ) бронхиальной астмы, острый стеноз гортани, отек Квинке, крапивницу, обострение аллергического конъюнктивита и/или аллергического ринита. Считается, что аллергическими заболеваниями страдает в среднем около 10% населения земного шара. Особую тревогу вызывают данные ННПО скорой медицинской помощи, согласно которым за последние 3 года число вызовов по поводу острых аллергических заболеваний в целом по РФ возросло на 18%.
Основные причины возникновения и патогенез
Патогенез аллергических реакций на сегодняшний день достаточно полно изучен и подробно описан во многих отечественных и зарубежных монографиях по аллергологии и клинической иммунологии. Центральная роль в реализации иммунопатологических реакций принадлежит иммуноглобулинам класса Е (IgE), связывание которых с антигеном приводит к выбросу из тучных клеток медиаторов аллергии (гистамина, серотонина, цитокинов и др.).
Наиболее часто аллергические реакции развиваются при воздействии ингаляционных аллергенов жилищ, эпидермальных, пыльцевых, пищевых аллергенов, лекарственных средств, антигенов паразитов, а также при укусах насекомых. Лекарственная аллергия чаще всего развивается при применении анальгетиков, сульфаниламидов и антибиотиков из группы пенициллинов, реже цефалоспоринов (при этом следует учитывать риск перекрестной сенсибилизации к пенициллину и цефалоспоринам, составляющий от 2 до 25%). Кроме того, в настоящее время возросло число случаев развития латексной аллергии.
Клиническая картина, классификация и диагностические критерии
С точки зрения определения объема необходимой лекарственной терапии на догоспитальном этапе оказания помощи и оценки прогноза острые аллергические заболевания можно подразделить на легкие (аллергический ринит — круглогодичный или сезонный, аллергический конъюнктивит — круглогодичный или сезонный, крапивница), средней тяжести и тяжелые (генерализованная крапивница, отек Квинке, острый стеноз гортани, среднетяжелое обострение бронхиальной астмы, анафилактический шок). Классификация и клиническая картина острых аллергических заболеваний представлены в табл. 1.
При анализе клинической картины аллергической реакции врач СМП должен получить ответы на следующие вопросы (табл. 2).
При начальном осмотре на догоспитальном этапе следует оценить наличие стридора, диспноэ, свистящего дыхания, одышки или апноэ; гипотензии или синкопе; изменений на коже (высыпаний по типу крапивницы, отека Квинке, гиперемии, зуда); гастроинтестинальных проявлений (тошноты, болей в животе, диареи); изменений сознания. Если у больного отмечаются стридор, выраженная одышка, гипотензия, аритмия, судороги, потеря сознания или шок, то данное состояние рассматривается как угрожающее жизни.
Лечение острых аллергических заболеваний
При острых аллергических заболеваниях на догоспитальном этапе неотложная терапия строится по следующим направлениям:
Прекращение дальнейшего поступления в организм предполагаемого аллергена.
Например, в случае реакции на лекарственный препарат, введенный парентерально, или при укусах насекомых — наложение жгута выше места инъекции (или укуса) на 25 мин (каждые 10 мин необходимо ослаблять жгут на 1-2 мин); к месту инъекции или укуса прикладывается лед или грелка с холодной водой на 15 мин; обкалывание в 5-6 точках и инфильтрация места инъекции или укуса 0,3-0,5 мл 0,1%-ного раствора адреналина с 4,5 мл изотонического раствора хлорида натрия.
Противоаллергическая терапия (антигистаминными препаратами или глюкокортикостероидами).
Введение антигистаминных препаратов (блокаторов Н1-гистаминовых рецепторов) показано при аллергическом рините, аллергическом конъюнктивите, крапивнице. Выделяют классические антигистаминные препараты (например, супрастин, димедрол) и препараты нового поколения (семпрекс, телфаст, кларотадин и др.). Необходимо отметить, что для классических антигистаминных препаратов в отличие от препаратов нового поколения характерно короткое время воздействия при относительно быстром наступлении клинического эффекта; многие из этих средств выпускаются в парентеральных формах. Антигистаминные препараты нового поколения лишены кардиотоксического действия, конкурентно влияют на гистамин, не метаболизируются печенью (например, фармакокинетика семпрекса не меняется даже у больных с нарушенными функциями печени и почек) и не вызывают тахифилаксии. Эти препараты обладают длительным воздействием и предназначаются для приема внутрь.
При анафилактическом шоке и при отеке Квинке (в последнем случае — препарат выбора) внутривенно вводится преднизолон (взрослым — 60-150 мг, детям — из расчета 2 мг на 1 кг массы тела). При генерализованной крапивнице или при сочетании крапивницы с отеком Квинке высокоэффективен бетаметазон (дипроспан в дозе 1-2 мл внутримышечно), состоящий из динатрия фосфата (обеспечивает быстрое достижение эффекта) и дипропионата бетаметазона (обусловливает пролонгированное действие). Для лечения бронхиальной астмы, аллергического ринита, аллергического конъюнктивита разработаны топические формы глюкокортикостероидов (флутиказон, будесонид). При отеке Квинке для предупреждения влияния на ткани гистамина необходимо комбинировать антигистаминные препараты нового поколения (семпрекс, кларитин, кларотадин) с глюкокортикостероидами (ГКС).
Побочные эффекты системных ГКС — артериальная гипертензия, повышенное возбуждение, аритмия, язвенные кровотечения. Побочные эффекты топических ГКС — осиплость голоса, нарушение микрофлоры с дальнейшим развитием кандидоза слизистых, при применении высоких доз — атрофия кожи, гинекомастия, прибавка массы тела и др. Противопоказания: язвенная болезнь желудка и 12-перстной кишки, тяжелая форма артериальной гипертензии, почечная недостаточность, повышенная чувствительность к глюкокортикоидам в анамнезе.
Симптоматическая терапия.
При развитии бронхоспазма показано ингаляционное введение b2-агонистов и других бронхолитических и противовоспалительных препаратов (беродуала, атровента, вентолина, пульмикорта) через небулайзер. Коррекцию артериальной гипотонии и восполнение объема циркулирующей крови проводят с помощью введения солевых и коллоидных растворов (изотонического раствора хлорида натрия — 500-1000 мл, стабизола — 500 мл, полиглюкина — 400 мл). Применение вазопрессорных аминов (допамина — 400 мг на 500 мл 5%-ной глюкозы, норадреналина — 0,2-2 мл на 500 мл 5%-ного раствора глюкозы, доза титруется до достижения уровня систолического давления 90 мм рт. ст.) возможно только после восполнения ОЦК. При брадикардии допускается введение атропина в дозе 0,3-0,5 мг подкожно (при необходимости инъекцию повторяют каждые 10 мин). При наличии цианоза, диспноэ, сухих хрипов показана также кислородотерапия.
Противошоковые мероприятия (см. рисунок).

При анафилактическом шоке больного следует уложить (голова ниже ног), повернуть голову в сторону (во избежание аспирации рвотных масс), выдвинуть нижнюю челюсть (при наличии съемных зубных протезов их нужно удалить).
Адреналин вводят подкожно в дозе 0,1-0,5 мл 0,1%-ного раствора (препарат выбора), при необходимости инъекции повторяют каждые 20 мин в течение часа под контролем уровня АД. При нестабильной гемодинамике с развитием непосредственной угрозы для жизни возможно внутривенное введение адреналина. При этом 1 мл 0,1%-ного раствора адреналина разводится в 100 мл изотонического раствора хлорида натрия и вводится с начальной скоростью 1 мкг/мин (1 мл в минуту). При необходимости скорость может быть увеличена до 2-10 мкг/мин. Внутривенное введение адреналина проводится под контролем частоты сердечных сокращений, дыхания, уровня артериального давления (систолическое артериальное давление необходимо поддерживать на уровне более 100 мм рт. ст. у взрослых и более 50 мм рт. ст. у детей).
Побочные эффекты адреналина — головокружение, тремор, слабость; сильное сердцебиение, тахикардия, различные аритмии (в том числе желудочковые), появление болей в области сердца; затруднение дыхания; увеличение потливости; чрезмерное повышение артериального давления; задержка мочи у мужчин, страдающих аденомой предстательной железы; повышение уровня сахара в крови у больных сахарным диабетом. Описаны также случаи развития некрозов тканей при повторном подкожном введении адреналина в одно и то же место вследствие местного сужения сосудов. Противопоказания — артериальная гипертензия; выраженный церебральный атеросклероз либо органическое поражение головного мозга; ишемическая болезнь сердца; гипертиреоз; закрытоугольная глаукома; сахарный диабет; гипертрофия предстательной железы; неанафилактический шок; беременность. Однако даже при этих заболеваниях возможно назначение адреналина при анафилактическом шоке по жизненным показаниям и под строгим врачебным контролем.
Типичные ошибки, допускаемые на догоспитальном этапе
Изолированное назначение Н1-гистаминовых блокаторов при тяжелых аллергических реакциях, равно как и при бронхообструктивном синдроме, не имеет самостоятельного значения, и на догоспитальном этапе это лишь приводит к неоправданной потере времени; использование дипразина (пипольфена) опасно усугублением гипотонии. Использование таких препаратов, как глюконат кальция, хлористый кальций, вообще не показано при острых аллергических заболеваниях. Ошибочным следует считать также позднее назначение ГКС, необоснованное применение малых доз ГКС, отказ от использования топических ГКС и b2-агонистов при аллергическом стенозе гортани и бронхоспазме.
Показания к госпитализации
Пациенты с тяжелыми аллергическими заболеваниями должны быть обязательно госпитализированы.
А. Л. Верткин, доктор медицинских наук, профессор
А. В. Тополянский, кандидат медицинских наук
Источник
Статья на конкурс «био/мол/текст»: Статья освещает механизм развития аллергии, традиционный способ лечения и его недостатки. Описан новаторский подход, который нашёл воплощение в виде синтетической полипептидной вакцины против аллергии на кошек и достиг небывалых успехов.
Как возникает аллергия?
Аллерген — это антиген, вызывающий аллергическую реакцию. Антиген (сокращено от antibody-generating) — это любая молекула, которая при попадании в организм индуцирует выработку антител. Чаще всего антигены имеют белковую природу.
При попадании в организм молекула аллергена фрагментируется антиген-презентирующими клетками (АПК) до коротких пептидных цепей (эпитопов). После этого эпитопы экспонируются на поверхность АПК в комплексе с молекулами главного комплекса гистосовместимости (MHC, Major Histocompatibility Complex). В таком виде они легко распознаются Т-лимфоцитами, а именно Т-хелперами 2 класса (Тh2), которые при этом активируются и начинают вырабатывать различные цитокины и стимулируют выработку В-лимфоцитами антител типа IgE [2].
Образовавшиеся IgE-антитела связываются с FсeRI — высокоаффинными рецепторами к Fc-фрагменту антител IgE, находящимися на поверхности тучных клеток слизистых и соединительных тканей. В результате эти клетки с «оружием» в виде антител IgE готовы реагировать на аллерген, если он повторно проникнет во внутреннюю среду организма (рис. 1).
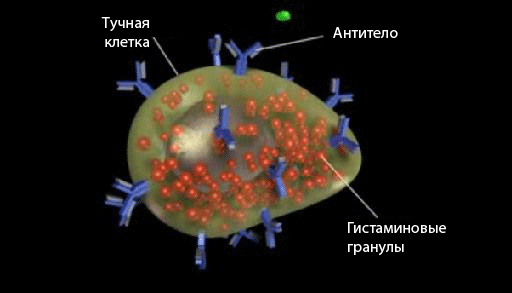
Рисунок 1. Тучная клетка с антителами IgE на поверхности и гранулами, наполненными гистамином, внутри.
Когда происходит связывание аллергена с антителом IgE, тучные клетки дегранулируются (разрываются) и начинают секретировать медиаторы: гистамин, простагландин D2 и др., которые при связывании с тканевыми рецепторами запускают развитие быстрой и замедленной фаз аллергической реакции. Подробнее о механизмах описанных процессов можно прочитать в [3]. Также я рекомендую замечательный учебник по иммунологии Ройта [4].
И тебя вылечат, и тебя тоже вылечат, и меня вылечат…
Радикальным и наиболее эффективным подходом для лечения аллергии в наше время является аллерген-специфичная иммунотерапия (АСИТ). Она позволяет влиять на проявления аллергии, вызванные образованием антиаллергических антител — иммуноглобулинов класса Е (IgE).
АСИТ заключается в последовательном введении в организм пациента возрастающих доз аллергена, к которому у больного выявлена повышенная чувствительность. Именно он вызывает клинические проявления заболевания.
По принципу действия терапия частично аналогична вакцинации против инфекционных болезней, формируя у «вакцинированного» аллергеном человека приобретенный иммунитет — быструю, эффективную и адекватную реакцию иммунной системы при контакте с аллергеном. Как и вакцинацию, АСИТ необходимо пройти заранее (до «встречи» с аллергеном) или в период изоляции от него. (Общую информацию об инфекционных вакцинах изучайте в статье «Вакцины в вопросах и ответах» [5].)
Видео. Интервью с аллергологом Тисленко Л.Н., которая доступно и занимательно рассказывает об АСИТ.
Ниже представлена выдержка из аннотации к одному из традиционных препаратов для проведения АСИТ:
Точный механизм действия аллергена при проведении аллерген-специфической иммунотерапии (АСИТ) до конца не ясен. Доказанными являются следующие биологические изменения: появление специфических антител (IgG4), играющих роль «блокирующих антител»; снижение уровня специфических IgE в плазме на длительный период; снижение реактивности клеток, участвующих в аллергической реакции; повышение активности взаимодействия между Т-лимфоцитами Th2 и Th2 и даже Th0, приводящее к положительному изменению продукции цитокинов (снижение IL-4 и повышение γ-интерферона), регулирующих продукцию IgЕ. Кроме этого, АСИТ вызывает иммунный ответ, что позволяет поддерживать иммунобиологическую память в течение длительного периода.
Компетентна АСИТ, прежде всего, в разнообразных респираторных аллергиях, где аллергены — пыль, клещ домашней пыли, пыльца растений, шерсть домашних животных.
АСИТ позволяет значительно облегчить течение или полностью вылечить такие проявления аллергии как ринит, конъюнктивит, не даёт развиться бронхиальной астме. Главное преимущество терапии — направленность на изменение реактивности иммунной системы организма. Как правило, эффект прохождения АСИТ сохраняется в течение всей жизни.
Вы его напрасно прелестным ругаете! *
* — цитата из фильма «Собачье сердце».
Основной недостаток АСИТ в настоящее время связан с происхождением применяемых лекарств. Все они представляют собой экстракты из природного аллергена. Несмотря на общий положительный исход терапии, побочные эффекты применения подобных препаратов остаются значительными. Это обусловлено тем, что мишенью «целого», не обработанного АПК аллергена являются иммуноглобулиновые «антенны» тучных клеток, и весь каскад аллергических реакций запускается заново, провоцируя иммунный ответ, аналогичный по природе самой болезни, однако в облегчённой форме, которая соответствует дозе введённого аллергена.
Кроме того, существуют некоторые сомнения относительно качества и происхождения аллерговакцин, предлагаемых медицинскими учреждениями. Неудивительно, ведь даже для лежащих в основе «фабричных» препаратов аллергенов не существует общепринятых стандартов и критериев, определяющих действие препарата. Мерой эффективности является титр антител IgE, вырабатываемых организмом. Получается, что измеряются параметры иммунной системы данного организма, а не действующего вещества (см. фармакокинетика, фармакодинамика). Конечно, существует статистика, но всё же такие лекарства остаются эмпирически эффективными.
Также значительными несовершенствами АСИТ являются её продолжительность и неудобство — как правило, лечение представляет собой курс инъекций с разной частотой (от трёх раз в неделю до раза в месяц) или таблетку ежедневно, и все это — в течение трёх-пяти лет.
Нельзя не упомянуть о высокой стоимости терапии, которая делает её осуществление невозможным для многих людей.
История невероятного успеха
Не более полугода назад компания Circassia, созданная на базе Оксфордского университета, представила ошеломительные результаты второй фазы клинических исследований синтетической полипептидной вакцины к аллергии на кошек. (С моделью, методами и результатами клинического исследования подробно можно ознакомиться в оригинальной статье [6].) Способность разработанной вакцины Tolero Mune устранять факторы, формирующие заболевание в целом, в три раза выше, чем у всех ныне известных лекарств, включая антигистаминные и стероидные препараты. Первые значительные результаты были отмечены в ходе годового исследования эффекта всего четырех инъекций, введённых в течение 12 недель (одна инъекция раз в три недели) [1].
Вакцина привлекла к себе ещё большее внимание, когда стали известны результаты двухгодичного исследования — 50%-облегчение назальных и окулярных проявлений аллергии по общему индексу риноконъюнктивных симптомов (T) (результат применения плацебо составил всего 14,9%).
Даже в «экстремальном» четырехдневном исследовании Tolero Mune не подвела: улучшение составило 38,3% (13,4% для плацебо). По словам Стива Харриса, руководителя Circassia, это небывалые результаты не только для аллергологии, но и для иммунологии в целом.
Природа вакцины — очевидный провал или гениальная идея?
Синтетические вакцины производят химически in vitro. Несмотря на полное копирование аминокислотной последовательности белка-аллергена, они отличаются низкой эффективностью и требуют добавки дополнительного иммунногенного компонента — адъюванта. Неудивительно — ведь то, насколько «крепко подружатся» антиген и антитело, во многом зависит от пространственной структуры белка, а не только от химического состава. Синтетические белки линейны — и это лишает их почти всех шансов стать хорошей вакциной.
В состав вакцины ToleroMune не входит даже адъювант. Идея кажется полностью провальной с самого начала, но как же создатели вакцины добились таких значительных результатов?
Рискованной, но гениальной стала идея применения эпитопов аллергена в качестве вакцины. Они являются совсем небольшими линейными пептидами и связываются незрелыми антиген-презентирующими клетками. За счёт наличия постоянного «аллергенного» фона Т-хелперы 2 не отвечают на каждую аллергоатаку обильной выработкой антител IgE, и каскад реакций с участием тучных клеток (а также их биосинтез) постепенно теряет былую интенсивность, и симптомы аллергии не развиваются. Происходит не «перехват» уже синтезированных антител IgE, а прекращение их синтеза в принципе. Браво!
Вкратце технология создания вакцины против аллергии на кошек Tolero Mune выглядела так:
- Изначально были выявлены те эпитопы кошачьего аллергена (Fel d1), которые связывались с молекулами главного комплекса гистосовместимости II (десятью самыми распространёнными HLA-DR рецепторами) на поверхности АПК и вызывали реакцию Т-лимфоцитов [6] (рис. 2).
- После этого эпитопы получили in vitro методом твердофазного пептидного синтеза с использованием F-moc защитной реакции и сделали тест in vivo для отбора тех эпитопов, которые привлекают именно ответственные за выработку антител IgE Т-хелперы 2 (Тh2). Кроме того, была проведена оценка фактора высвобождения гистамина для каждого из эпитопов (рис. 3).
- Из «элиты» сформировали вакцину — набор из семи пептидов, каждый из которых содержит один или два Тh2-активирующих эпитопа.
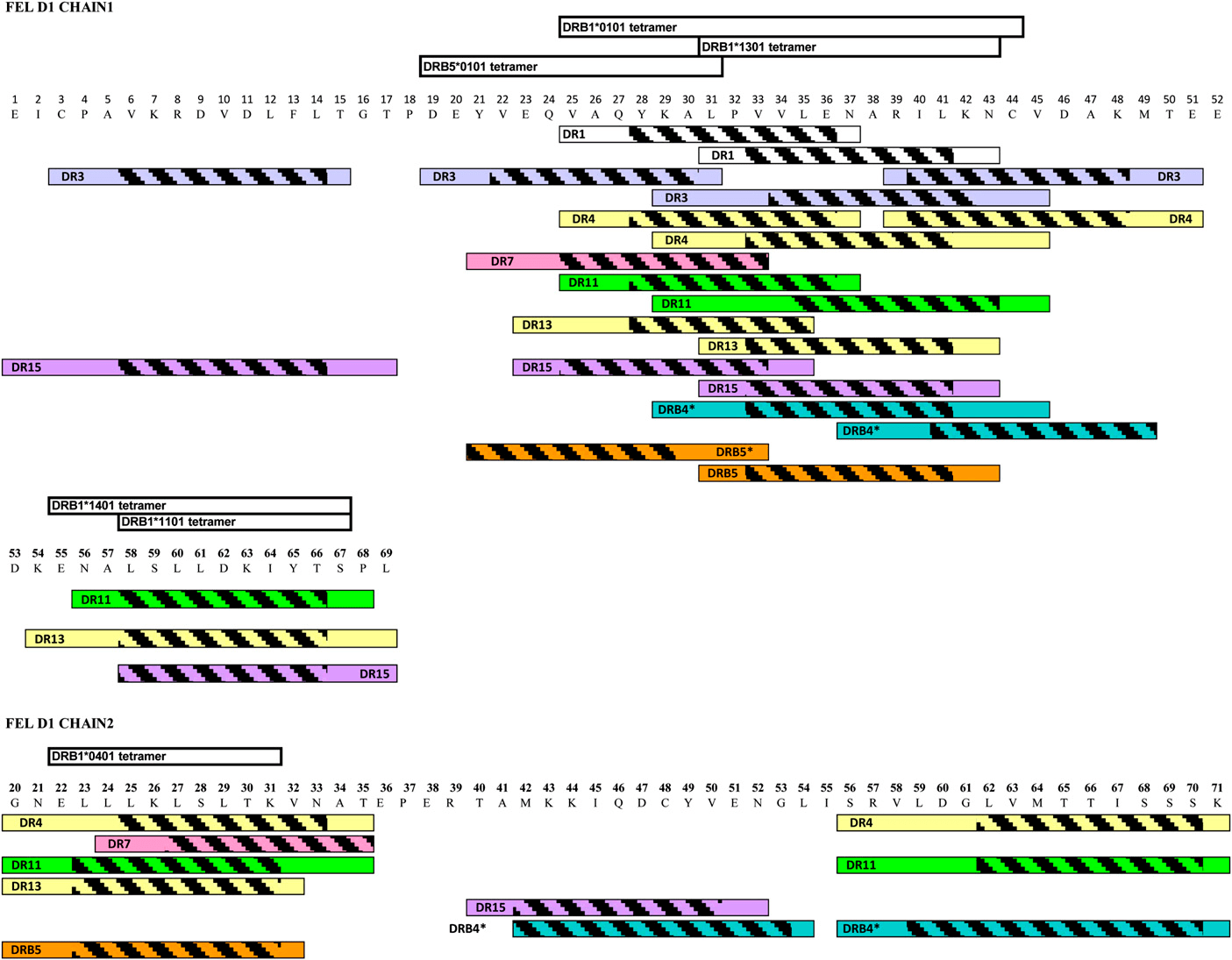
Рисунок 2. Полная карта эпитопов аллергена Fel d1. Штриховкой выделены области связывания с MHC II.
Получается, вакцина оксфордских учёных разом устранила основные недостатки АСИТ:
- Отсутствие побочной реакции, аналогичной самой болезни, как в случае с применением цельного аллергена.
- Значительное сокращение времени лечения и облегченная форма введения — всего четыре инъекции в течение 12 недель. Также в настоящее время ведутся разработки альтернативных схем лечения и лекарственных форм.
- Синтетический путь получения вакцины позволяет снизить её стоимость и сделать доступной для большего числа больных.
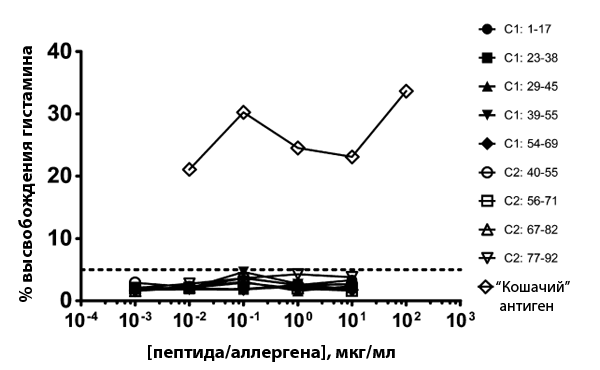
Рисунок 3. График зависимости высвобождения гистамина от природы эпитопа. Он показывает, что для всех синтезированных эпитопов фактор значительно ниже, чем у цельного экстракта «кошачьего» аллергена.
Всё перечисленное — это огромная помощь людям, которые страдают от аллергии постоянно: во время цветения деревьев и трав, при каждой встрече с кошкой или пылью…
В добрый путь!
Сейчас компания разрабатывает на основе описанного метода вакцины к аллергиям на травянистые растения, клеща домашней пыли и амброзию.
Пожелаем им удачи и будем с нетерпением ждать, когда такие вакцины станут популярными и общедоступными по всему миру, делая чью-то жизнь более здоровой и счастливой!
- Randy Osborne. (2013). Synthetic peptide allergy vaccine shows efficacy. Nat Biotechnol. 31, 371-372;
- Ильина Н.И. и Курбачева О.М. (2004). Вакцинопрофилактика аллергии. Вакцинопрофилактика неинфекционных заболеваний. 4;
- «Реакции гиперчувствительности I типа — тучные клетки и базофилы». Immunonfo.ru;
- Ройт А., Бростофф Дж., Мейл Д. Иммунология. М.: Мир, 2000. — 592 с.;
- Вакцины в вопросах и ответах;
- Margitta Worm, Hae-Hyuk Lee, Jörg Kleine-Tebbe, Roderick P. Hafner, Paul Laidler, et. al.. (2011). Development and preliminary clinical evaluation of a peptide immunotherapy vaccine for cat allergy. Journal of Allergy and Clinical Immunology. 127, 89-97.e14.
Источник